Welfare
Malattie rare: «e ora non dimentichiamo la ricerca di base»
Lucia Monaco presiede l'assemblea di IRDiRC, il consorzio internazionale che vuole contribuire all’obiettivo di mille nuove terapie per le malattie rare entro il 2027. «Rete è una parola cruciale, perché è proprio la visione d’insieme ciò che ha cambiato lo scenario», dice. La sfida per il futuro? «Mai smettere di investire nella ricerca di base»

“Reti” è una parola importantissima per le malattie rare, «perché è proprio la visione d’insieme che ha cambiato lo scenario». Ne è convinta Lucia Monaco, responsabile del Centro Studi di Fondazione Telethon e presidente dell’assemblea di IRDiRC, il consorzio nato nel 2011 che raccoglie oggi 62 organizzazioni da tutto il mondo, tra enti finanziatori della ricerca sulle malattie rare (governativi e non), aziende e organizzazione di pazienti. «Si è passati a tutti i livelli da un approccio centrato sulla singola malattia a uno che guarda alle malattie rare come categoria. Si è compreso che per essere efficaci occorre mettere insieme tutti gli attori: ricercatori, clinici, aziende, enti finanziatori, enti regolatori e anche il paziente, che sempre più è presente non solo come obiettivo della terapia ma come soggetto che partecipa». L’obiettivo di IRDiRC è far sì che ogni persona con una malattia rara possa avere accesso a diagnosi e cure disponibili entro un anno».
Qual è l’elemento cruciale del cambiamento avvenuto sulle malattie rare?
Mi fa piacere che si colga l’importanza della rete, perché è proprio la visione d’insieme ciò che ha cambiato lo scenario. Si è passati da un approccio che affronta la singola malattia a uno di visione di sistema. Dal punto di vista prettamente scientifico vanno citati gli avanzamenti nella genomica e il fatto che con le nuove tecnologie di sequenziamento del DNA, unite a strumenti di analisi bioinformatica e di condivisione dei dati, è possibile collegare i dati di più malattie. Fuori dall’ambito prettamente genetico e di ricerca, si è sviluppata la consapevolezza che per affrontare le malattie rare occorre la collaborazione di attori diversi, a partire dai ricercatori e dagli enti che finanzino ricerca, che devono collaborare con tutti gli attori che permettono, partendo dai risultati accademici, di arrivare alla clinica e al paziente.
I pazienti sono centrali. Questo è quello che è balzato veramente all’attenzione di tutti: la persona. Il paziente sempre più esiste ed è considerato non solo come obiettivo della terapia ma come attore che partecipa consapevolmente al processo, innanzitutto nella definizione degli obiettivi di uno studio di ricerca.
Chi sono gli attori di questa filiera?
Occorre ricordare in particolare che per le malattie rare gli studi clinici hanno a disposizione numeri diversi da quelli della farmacologia tradizionale, con pochi o pochissimi pazienti: tutto questo richiede approcci differenti nel disegno delle studio. Per questo è diventato fondamentale “portare a bordo” gli enti regolatori. La tutela della sicurezza del paziente è un principio non derogabile ma va applicato con nuovi criteri; basti pensare alla terapia genica e a quella cellulare, che comportano un processo di sviluppo industriale molto diverso da quello tradizionale, talvolta con un farmaco personalizzato che è costituito dalle cellule stesse del paziente opportunamente ingegnerizzate. Quindi è necessario coinvolgere le aziende, a partire dalle startup che nascono dall’ambito accademico fino alle grandi aziende farmaceutiche che decidono di investire sulle malattie rare.

In tutto questo, di nuovo, gli enti regolatori hanno un ruolo importante: si pensi agli incentivi associati alla designazione di farmaco orfano, che hanno rappresentato un passo avanti per stimolare il coinvolgimento delle aziende nello sviluppo di terapie per le malattie rare. A questo proposito, oggi c’è grande attenzione in Europa per la prossima revisione della normativa sulla designazione di farmaco orfano, affinché non vengano meno tali incentivi. Andando avanti nella filiera, l’ultimo tassello è l’accesso alle terapie approvate per la commercializzazione, con il tema del prezzo e della sostenibilità per i diversi sistemi sanitari nazionali, perché una terapia che si è dimostrata efficace arrivi veramente al paziente.
Qual è invece il ruolo delle associazioni di pazienti?
I pazienti sono centrali. Questo è quello che è balzato veramente all’attenzione di tutti: la persona. Il paziente sempre più esiste ed è considerato non solo come obiettivo della terapia ma come attore che partecipa consapevolmente al processo.
In che modo sta partecipando?
Innanzitutto nella definizione degli obiettivi di uno studio di ricerca. Si è riusciti a stimolare i ricercatori affinché il quesito scientifico sia rilevante non solo per aumentare la conoscenza sulla malattia studiata, ma anche per la sua possibile ricaduta sul paziente. Anche il ruolo dei finanziatori in questo senso è importante, perché chi finanzia può inserire questo obiettivo fra i criteri di valutazione. Soprattutto quelle realtà che finanziano una malattia specifica possono scegliere di avere nelle commissioni di valutazione rappresentanti di pazienti e famigliari. Per Fondazione Telethon ciò è difficile perché ci occupiamo di tutte le malattie genetiche rare; tuttavia, nel nostro advisory board scientifico, che guida le nostre decisioni strategiche sugli investimenti in ricerca, ci sono consiglieri che rappresentano i pazienti. L’impatto sul paziente è uno dei parametri che applichiamo nella valutazione dei progetti da finanziare, che consente di privilegiare un progetto che ha una prospettiva di impatto per il paziente più immediata, a parità di robustezza scientifica ed innovatività. Questo è solo un esempio applicato da Fondazione Telethon; il concetto chiave è che chi finanzia ricerca sia consapevole dell’importanza di fare ricerca di base e studiare le cause e i meccanismi molecolari, perché da lì nasca quella conoscenza che permette di identificare un possibile approccio terapeutico: l’obiettivo è sempre quello di trovare una soluzione alla malattia.
Qual è, in questo quadro complesso, il ruolo di IRDiRC?
Guardando a questa complessità, sono nate iniziative come IRDiRC, che mette attorno al tavolo attori diversi che possano condividere problemi, conoscenze e competenze, venendo da diverse parti del mondo, da contesti diversi per disponibilità di risorse e infrastrutture, con sistemi di cura diversi… tutti uniti per affrontare i problemi insieme. È stata un’idea visionaria perché si è riconosciuto che alcuni temi e problemi possono essere affrontati con linee guida, raccomandazioni e strumenti informatici che non vengono più dal singolo ma beneficiano di una collettività di esperti che rappresenta la comunità delle malattie rare. Questo è il vero valore aggiunto di una realtà che non ha un suo portafogli ma che è composta da organizzazioni che nel proprio ambito specifico potranno prendere decisioni di investimenti, facendosi ispirare e guidare dagli studi e analisi di scenario fatti insieme. IRDiRC è una realtà mondiale, nata originariamente per iniziativa congiunta della Commissione Europea e dei National Institutes of Health degli USA: due grossi enti che finanziano ricerca, che hanno deciso di unire le forze su un tema trasversale a livello globale. Si sono aggiunte molte realtà dall’Europa, Nord America, Cina, Giappone, Australia, India, di recente dall’Africa e dal Sudamerica…. In tutto siamo 62 organizzazioni, con una buona rappresentazione anche se non ancora una copertura completa a livello globale.
Cosa fa, concretamente, IRDiRC?
L’assemblea dei membri IRDiRC – che mi onoro di presiedere per il triennio 2019 -2021 – si riunisce fisicamente o per teleconferenza ogni tre mesi, ed è adiuvata da comitati scientifici che affrontano tre tematiche principali: diagnosi, terapia e temi interdisciplinari di gestione e condivisione dei dati e delle risorse biologiche. Insieme, lavoriamo per identificare le tematiche più urgenti ed attuali da affrontare con task force operative, gruppi di esperti che lavorano ad un tema specifico in un tempo limitato e producono linee guida o raccomandazioni o strumenti informatici che vengono poi diffuse agli enti che possano implementarle e a tutta la comunità scientifica in generale. Per esempio, uno dei primi prodotti di IRDiRC, nel 2013/14, è stato Matchmaker Exchange, una piattaforma informatica che permette di confrontare le informazioni genetiche di pazienti che afferiscono a laboratori da tutto il mondo, con una standardizzazione dei dati e di approcci di analisi. Questo strumento ha un’importanza notevole per la diagnosi delle malattie rare. Sappiamo che i casi più rari sono ancora senza diagnosi e spesso affrontano un’“odissea” diagnostica. Ma per identificare un difetto genetico occorre riscontrarlo in un secondo paziente con lo stesso fenotipo. È questo che permette di validare la diagnosi; diversi second case sono stati identificati grazie alla piattaforma. Dare un nome alla malattia non offre un’immediata soluzione, ma è un punto di partenza che permette alle famiglie di uscire dall’oscurità e offre ai ricercatori un indizio importantissimo., Conoscere il difetto genetico alla base di una malattia dà il via a una serie di indagini mirate a identificare un’ipotesi per investigare un approccio terapeutico. Questa conoscenza insomma è il passo indispensabile affinché si avvii un percorso di ricerca, che per le famiglie potrebbe essere lungo ma certamente apre una speranza. Anche Fondazione Telethon ha un programma per le malattie non diagnosticate e diverse famiglie esprimono riconoscenza per questa uscita dal buio, pur consapevoli che la strada per una possibile terapia è lunga.
Uno dei primi prodotti realizzati da IRDiRC è stato Matchmaker Exchange, una piattaforma informatica che permette di confrontare le informazioni genetiche di pazienti che afferiscono a laboratori da tutto il mondo, con una standardizzazione dei dati e di approcci di analisi. Questo strumento ha un’importanza notevole per la diagnosi delle malattie rare.
Quali sono le sfide per il futuro?
Vedo due sfide. Da una parte c’è senza dubbio la sfida dello sviluppo di nuovi farmaci e l’accesso ad essi, cui si associa il non piccolo tema della sostenibilità. Stiamo assistendo a successi entusiasmanti per malattie che fino a pochi anni fa sembravano non avere speranze… le soluzioni invece si stanno dimostrando realistiche. Però c’è il tema di come sarà possibile per i servizi sanitari nazionali sostenere queste terapie per un numero sempre maggiore di terapie e quindi di pazienti. In particolare per le terapie geniche, i costi sono oggi altissimi. Ovviamente possiamo immaginare che ci saranno economie di scala, basti pensare a quanto costava una fiala di penicillina negli anni ‘40 rispetto ad oggi… ma in molti casi queste terapie sono personalizzate quindi non è possibile una produzione su larga scala. Queste terapie richiedono un modello di business diverso, che non è quello attuale.
Vedo due sfide. Da una parte lo sviluppo di nuovi farmaci e l’accesso ad essi, cui si associa il non piccolo tema della sostenibilità. Dall'altra continuare a sostenere la ricerca di base, perché vedo grande attenzione alla parte finale della filiera ma tutto ciò ha senso se avanza anche la conoscenza sulle altre malattie rare, su cui ancora non ci sono studi.
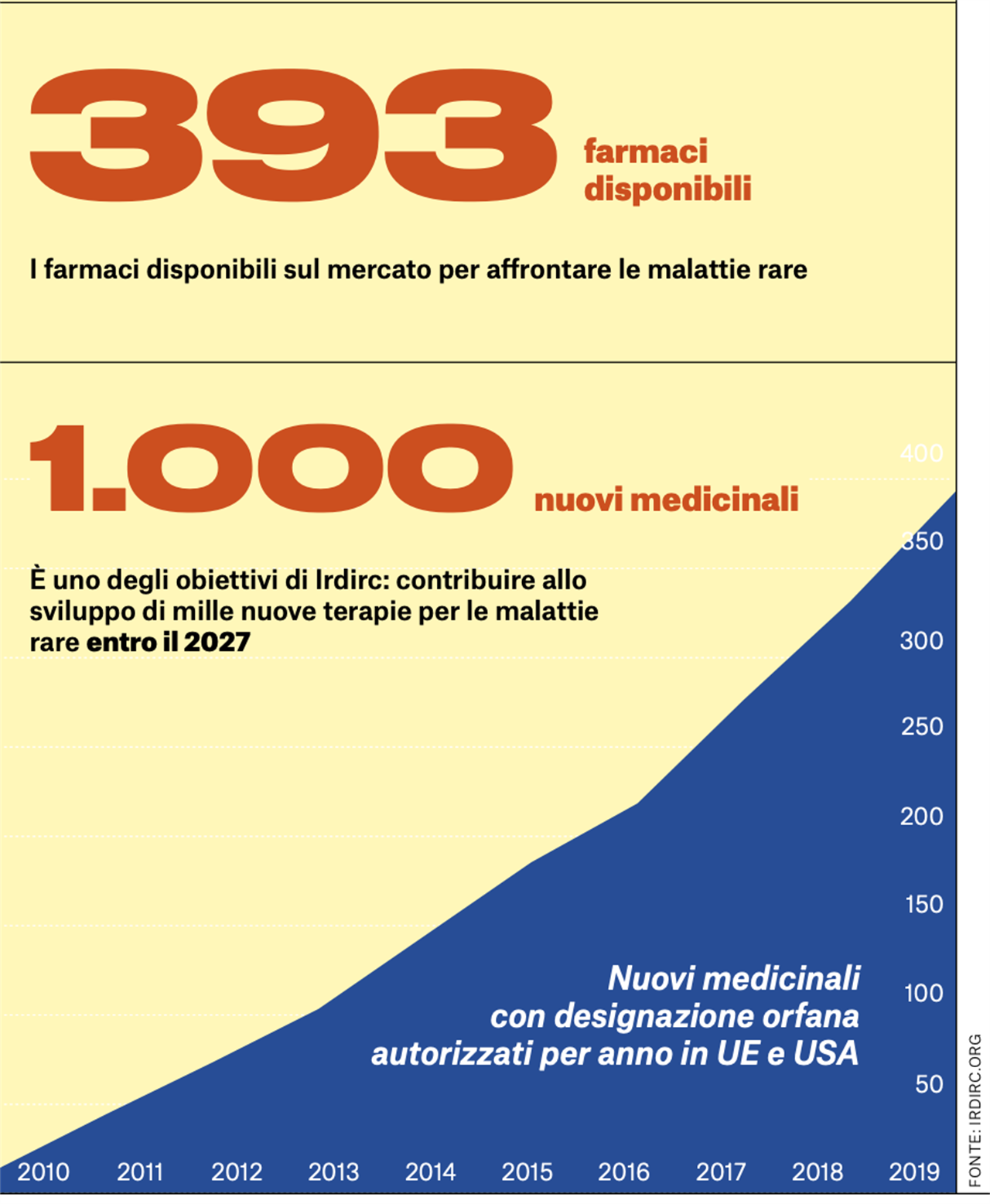
Uno degli obiettivi di IRDiRC è contribuire all’obiettivo di mille nuove terapie per le malattie rare entro il 2027. È possibile?
È sfidante, ma possibile. Non tutte le 6mila malattie rare potranno essere trattate con la terapia genica, proprio per la loro natura. Per alcune malattie sarà possibile identificare farmaci tradizionali, come piccole molecole, magari già sperimentati e approvati per malattie più comuni, oppure farmaci biologici, per esempio a base di RNA.
La seconda sfida?
È continuare a dare sostegno alla ricerca di base, perché vedo grande attenzione alla parte finale della filiera, allo sviluppo delle terapie, all’interazione con gli enti regolatori, alla sostenibilità del sistema sanitario nazionale… ma tutto ciò ha senso se avanza anche la conoscenza sulle altre malattie rare, su cui ancora non ci sono studi. La ricerca di base non va mai persa di vista. Sappiamo tutti quante e quali sfide relative alla salute pubblica richiedano investimenti importanti: malattie infettive, cancro, malattie non trasmissibili, invecchiamento … È vero tuttavia che la ricerca sulle malattie rare – in particolare quelle genetiche – porta conoscenze e soluzioni che si applicano anche a malattie più comuni: è un investimento che paga perché ha ricadute più ampie dei suoi obiettivi specifici. È tutto l’ecosistema che alla fine deve essere sostenibile. Di nuovo torniamo alla necessità di un approccio d’insieme: nessun singolo attore può affrontare, da solo, le sfide che ci attendono.
Vuoi accedere all'archivio di VITA?
Con un abbonamento annuale potrai sfogliare più di 50 numeri del nostro magazine, da gennaio 2020 ad oggi: ogni numero una storia sempre attuale. Oltre a tutti i contenuti extra come le newsletter tematiche, i podcast, le infografiche e gli approfondimenti.
